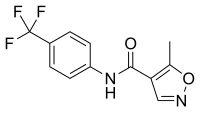
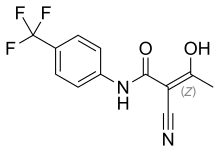DI: www.scienzavegetariana.it/nutrizione/pcrm/pcrm_sm.html
La maggior parte dei Professionisti della Salute respinge l'idea che
la Sclerosi Multipla (SM), una malattia degenerativa del Sistema
Nervoso, possa essere correlata alla dieta. Sembra loro ridicolo che
una malattia così misteriosa possa venire influenzata da qualcosa di
tanto semplice. Piuttosto che cercare le risposte nella cucina, la
classe medica si attende che un trattamento per la Sclerosi Multipla
provenga da ricerche di alta tecnologia che ne individuino con esattezza
l'agente responsabile - un virus, forse, od una sregolazione del
sistema immunitario.
Cionondimeno, se si richiedesse ad un medico o ad un dietologo
qualche prova tangibile del fatto che la dieta non abbia alcuna
relazione con la causa od il trattamento della SM, non potrebbero
trovarla. Non esiste ancora uno Studio che affermi che la dieta non
aiuti i malati di SM. Infatti, tutte le prove scientifiche disponibili
hanno indicato nella dieta l'approccio più proficuo.
La Sclerosi Multipla è la più diffusa malattia
flogistico-degenerativa a carico del Sistema Nervoso negli USA, e
colpisce principalmente individui tra i 15 e i 55 anni di età. E'
caratterizzata dalla formazione di numerose lesioni -intese come
multiple sedi di danno anatomico (di natura infiammatoria, NdT)- a
carico di cellule nervose dell'encefalo e/o del midollo spinale. Queste
lesioni (infiammatorie) sono in seguito sostituite da tessuto
cicatriziale duro (placche, NdT), che impedisce il funzionamento della
trasmissione nervosa. I quasi 500.000 americani affetti da SM
manifestano ricorrenti episodi (poussées, NdT) di deficit a carico del
Sistema Nervoso, che esitano in una progressiva perdita di funzioni. Un
episodio può colpire la vista; un altro può causare la perdita del
controllo vescicale; pochi mesi dopo, un braccio o una gamba possono
perdere la forza. Dopo dieci anni di malattia, la metà dei pazienti
affetti da SM sono severamente disabili, allettati, in carrozzina o
peggio.
La Sclerosi Multipla è una malattia comune in Canada, U.S.A ed
Europa del Nord, ma rara in Africa ed Asia. Se un soggetto migra da un
Paese a bassa incidenza di SM (e quindi inevitabilmente cambia il
proprio stile di vita e la propria dieta), il rischio di contrarre la SM
aumenta. Molti Studi hanno analizzato i fattori ambientali che
potrebbero influire sulla diversa incidenza della malattia fra le
diverse popolazioni. Il fattore principale sembra essere quello che
rappresenta il più forte elemento di contatto con l'ambiente: il cibo
che viene assunto quotidianamente.
Sebbene i Paesi ricchi in genere abbiano tassi più elevati di SM e i
Paesi meno ricchi abbiano minori tassi di incidenza, esiste
un'eccezione: il Giappone. Anche se i Giapponesi vivono in un Paese
moderno, industrializzato, con tutto lo stress, l'inquinamento, e le
abitudini al fumo comuni alle altre Nazioni industrializzate, la loro
dieta a base di riso è più simile a quella dei Paesi poveri dove la SM è
meno comune. Il caso Giappone fornisce una valida evidenza di come una
dieta ricca di cibi animali, piuttosto che altre "moderne" calamità,
possa costituire la base per l'insorgenza di SM.
Naturalmente, tutti i componenti di una dieta a base di cibi ricchi
possono causare problemi, ma i grassi animali -specialmente quelli
derivanti dai latticini - sono quelli più strettamente correlati allo
sviluppo della SM [1]. Una teoria ipotizza che un'alimentazione
infantile a base di latte vaccino crei i presupposti per la comparsa di
danni al Sistema Nervoso nel corso della vita. Il latte vaccino
possiede solo un quinto dell'acido linoleico (un acido grasso
essenziale) del latte materno. L'acido linoleico è il costituente
principale dei tessuti nervosi. Può essere verosimile che bambini
cresciuti con una dieta ricca di grassi animali e povera in acido
linoleico (come la maggior parte di bambini nella nostra società)
sviluppino un Sistema Nervoso più vulnerabile nel corso della crescita.
L'analisi dei tessuti cerebrali dimostra che i soggetti affetti da SM
hanno un contenuto di grassi saturi nell'encefalo superiore a quello
degli individui sani [2].
Il fattore scatenante la pousée di SM è ignoto, ma possibili agenti
sospetti sono virus, reazioni allergiche, e disturbi del flusso ematico
al cervello. Molto probabilmente, l'agente eziologico è in connessione
con sistema circolatorio dell'encefalo o del midollo spinale, perchè le
caratteristiche lesioni e cicatrici della SM sono localizzate nelle
cellule nervose nelle vicinanze dei vasi sanguigni.
Un'altra teoria ipotizza che le riesacerbazioni di SM siano sostenute
da un ridotto apporto ematico a zone di tessuto cerebrale vulnerabile.
I grassi alimentari possono avere questo effetto. Entrano nella
corrente ematica e ricoprono le cellule del sangue. Il risultato è che
le cellule si aggregano, formando dei conglomerati che rallentano la
perfusione ematica ai tessuti vitali. Il sangue non forma dei coaguli,
come si verifica nell'ictus cerebrale, ma in molti vasi sanguigni questi
aggregati diventano così rilevanti da arrestare il flusso ematico, il
che provoca un decremento rapido del contenuto totale di Ossigeno del
sangue [3, 4]. I tessuti privati di sangue e Ossigeno per periodi di
tempo prolungati vanno incontro a necrosi. Può qualcosa di così banale
costituire un fattore di rischio per la progressione della SM?
Come esempio, possiamo valutare lo stato di salute di individui
costretti ad una dieta povera di grassi. Durante la Seconda Guerra
Mondiale, il cibo era scarso e lo stress elevato nell'Europa Occidentale
occupata. La gente non poteva più permettersi la carne, così mangiava i
cereali e le verdure che un tempo utilizzavano per nutrire le vacche, i
polli ed i maiali. Il risultato fu una drammatica diminuzione
dell'assunzione di prodotti di origine animale e di grassi totali nella
dieta. I medici osservarono che i ricoveri per SM erano diminuiti di
2-2.5 volte durante il periodo bellico [5].
Roy Swank, M.D., ex-direttore del Dipartimento di Neurologia
dell'Università dell'Oregon ed ora medico all'Oregon Health Sciences
University, osservò che i pazienti con MS erano migliorati quando
sottoposti a questa dieta forzatamente povera di grassi. Negli anni
'50, Swank ha iniziato a trattare i propri pazienti con una dieta di
questo tipo. Avendo ottenuto risultati eccellenti, ha trattato per 35
anni migliaia di pazienti affetti da SM in questo modo. I suoi
risultati sono apprezzabili alla luce di qualunque criterio medico
standard: le condizioni dei pazienti sono migliorate nel 95% dei casi
[6]. I pazienti andavano meglio se la malattia era stata diagnosticata
precocemente ed avevano avuto poche poussées, ma anche i pazienti malati
di SM da lungo tempo hanno mostrato un rallentamento nella progressione
della malattia. In origine Swank era soprattutto impegnato nel
limitare i grassi saturi, ma col passare degli anni ha iniziato a
considerare pericolosi tutti i tipi di grassi. La sua dieta per la MS
attualmente ha un apporto di grassi del 20% delle calorie totali.
I risultati di Swank non sono mai stati messi in discussione da altri
Studi. Ma invece di sostenere l'opportunità di una dieta vegetariana a
basso tenore di grassi per i propri pazienti, molti medici ignorano o
scartano il lavoro di Swank perchè pensano che seguire una dieta del
genere sia troppo complicato. Quando ho chiesto a Swank perchè i suoi
Studi siano stati in gran parte ignorati dall'establishment medico, egli
mi ha risposto: "John, sono un ragazzino in questo piccolo laboratorio
universitario. I loro fondi di ricerca non hanno pagato per questo,
perciò, come potrebbe essere importante?"
Tre dati importanti sono emersi dalle Ricerche di Swank:
- Quanto prima un malato di SM adotta una dieta con pochi grassi,
tanto maggiore è la probabilità di evitare peggioramenti clinici e morte
dovuti alla malattia..
- I pazienti che hanno limitato l'assunzione di grassi saturi
a meno di 20 gr. al giorno non hanno più mostrato la progressione
clinica tipica della malattia (la maggior parte degli americani mangia
125 grammi o più di grassi al giorno).
- Tra i pazienti il cui apporto di grassi saturi è stato
uguale od inferiore a 17 grammi al giorno, il tasso di mortalità dopo un
follow-up di 35 anni è risultato essere del 31%- simile al tasso della
popolazione normale. Il tasso di mortalità si è attestato intorno al
21% per i pazienti che si sono attenuti a questi bassi livelli di
assunzione di grassi e che hanno iniziato la dieta entro tre anni dalla
diagnosi della malattia. Dall'altro versante, i pazienti che hanno
consumato più di 25 grammi di grassi saturi al giorno hanno manifestato
un tasso di mortalità del 79% nel periodo dello Studio; quasi la metà
dei decessi erano riconducibili direttamente alla SM.
La differenza di 8 grammi nell'apporto giornaliero di grassi saturi
(che triplica il tasso di mortalità di SM) può essere apparentemente
trascurabile, ad esempio:
- 1 oncia di salsiccia di maiale (10 gr)
- 1 hamburger a medio contenuto di grassi (14 gr)
- 3 once di costata di manzo (14 gr)
- 1 oncia di formaggio cheddar (9 gr)
- 2 cucchiaini da the di burro (8gr)
- 1 tazza di latte intero (8 gr)
Questi risultati sono chiari. Per arrestare la SM la dieta deve
contenere meno grassi saturi possibile, circa il 6% delle calorie
totali. Ciò si traduce in una dieta vegetariana a basso tenore di
grassi composta da polisaccaridi, verdura, frutta, -cibi deliziosi che
contengono solo il 5-10 percento dei grassi totali-. Se si eliminano le
uova, i latticini e gli olii tropicali come l'olio di cuori di palma e
di cocco, non sarà possibile assumere grassi saturi.
Oltre ad arrestare la SM, una dieta vegetariana a basso tenore di
grassi porta a un calo ponderale negli obesi, riduce la stipsi, e
riduce la spesa per alimenti del 40%. Infatti, questo tipo di dieta è
in linea con le raccomandazioni fatte da altre organizzazioni della
Sanità (incluse l'American Cancer Society, l'American Heart Association e
il Surgeon General Office), che raccomandano agli Americani a mangiare
meno grassi, carne, e latticini, aumentando l'assunzione di cereali
integrali, verdura e frutta.
Io tratto i miei pazienti con una dieta vegetariana integrale senza
olii aggiuti, uova o latticini. I cibi sono comuni - fiocchi d'avena,
cereali freddi, frittelle per colazione; zuppe e panini alle verdure per
pranzo; spaghetti, burritos di fagioli, chili e verdure saltate per
cena.
Sono stato molto gratificato dai risultati di questo trattamento
dietetico, non solo perché ho ottenuto l'arresto della progressione di
malattia di molti dei miei pazienti, ma anche perché la loro salute
globale è indiscutibilmente migliorata. E tutti sanno quanto i malati
di SM abbiano bisogno di ogni aiuto possibile, per quanto piccolo.